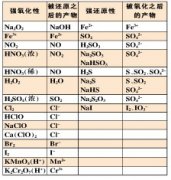
高中化学知识点本章节为大家介绍的是离子反应与共存的知识点,电解质在溶液里所起的反应,实质上就是离子之间的相互反应。
离子间的反应是趋向于降低离子浓度的方向进行。离子反应通常用离子方程式来表示。理解掌握离子反应发生的条件和正确书写离子方程式是学好离子反应的关键。溶液中离子共存的问题,取决于离子之间是否发生化学反应,如离子间能反应,这些离子就不能大量共存于同一溶液中。
(一). 离子反应发生的条件
1. 离子反应生成微溶物或难溶物。
2. 离子反应生成气体。
3. 离子反应生成弱电解质。
4. 离子反应发生氧化还原反应。
根据化学反应类型,离子反应可分为两类,一是酸碱盐之间的复分解反应;二是氧化性离子与还原性离子间的氧化还原反应。离子反应还应注意:
1.微溶物向难溶物转化,如用煮沸法软化暂时硬水
MgHCO3==MgCO3+CO2↑+H2O MgCO3虽然难溶,但在溶液中溶解的哪部分是完全电离的,当Mg2+遇到水溶液里的OH-时会结合生成比MgCO3溶解度更小的Mg(OH)2而沉淀析出MgCO3+H2O==Mg(OH)2 ↓+ CO2↑
2.生成络离子的反应:
FeCl3溶液与KSCN 溶液的反应:Fe3+ + SCN- ==Fe(SCN)2+ 生成物既不是沉淀物也不是气体,为什么反应能发生呢?主要是生成了难电离的Fe(SCN)2+络离子。
3.优先发生氧化还原反应:
具有强氧化性的离子与强还原性的离子相遇时首先发生氧化还原反应。例如:Na2S溶液与FeCI3溶液混合,生成S和Fe2+离子,而不是发生双水解生成Fe(OH)3沉淀和H2S气体。2Fe3+ + S2- = 2Fe2+ + S ↓
总之:在水溶液里或在熔融状态下,离子间只要是能发生反应,总是向着降低离子浓度的方向进行。反之,离子反应不能发生。
(二). 离子反应的本质:反应体系中能够生成气、水(难电离的物质)、沉淀的离子参与反应,其余的成分实际上未参与反应。
(三).离子反应方程式的类型
1. 复分解反应的离子方程式。 2. 氧化还原反应的离子方程式。
3. 盐类水解的离子方程式。 4. 络合反应的离子方程式。
掌握离子方程式的类型及特征,写好离子方程式,正确书写离子方程式是学生必须掌握的基本技能。
当前位置:主页 > 考试 > 学历类 > 高考 > 各科备考 > 高考化学备考 > >
高中化学知识点:离子反应与共存
来源::未知 | 作者:搜狐体育直播_欧洲五大联赛-投注官网 | 本文已影响 人
- 上一篇:高考化学知识点:氧化还原反应考点整理
- 下一篇:高中化学课程改革下高考化学的特点
随机阅读
- [高考化学备考] 怎样掌握高中化学学习方法
- [高考化学备考] 化学解决计算题失分的步骤
- [高考化学备考] 高考化学知识点:常见的氧
- [高考化学备考] 高中化学学习中总结的四个
- [高考化学备考] 高三化学知识点 化学反应
- [高考化学备考] 高考化学复习指导:轻重分
- [高考化学备考] 高考化学知识点:带颜色的
- [高考化学备考] 怎样做化学元素推断题
- [高考化学备考] 理综化学大题高分技巧
- [高考化学备考] 高中化学离子方程式判断
- [高考化学备考] 高中化学方程式总结
- [高考化学备考] 高考化学学习防范:化学知
- [高考化学备考] 高中化学易错知识点
- [高考化学备考] 高考化学复习方法: 改变
- [高考化学备考] 高三化学知识点 电解质
- [高考化学备考] 化学教学中渗透绿色化学教